Sкандиум, со симбол на елементот Sc и атомски број 21, лесно е растворлив во вода, може да реагира со топла вода и лесно потемнува во воздух. Неговата главна валентност е +3. Често се меша со гадолиниум, ербиум и други елементи, со низок принос и содржина од приближно 0,0005% во кората. Скандиумот често се користи за производство на специјално стакло и лесни легури за високи температури.
Во моментов, докажаните резерви на скандиум во светот се само 2 милиони тони, од кои 90~95% се содржани во бокситни, фосфоритни и железни титаниумски руди, а мал дел во ураниумски, ториумски, волфрамски и ретки земни руди, главно распространети во Русија, Кина, Таџикистан, Мадагаскар, Норвешка и други земји. Кина е многу богата со ресурси на скандиум, со огромни минерални резерви поврзани со скандиум. Според нецелосни статистички податоци, резервите на скандиум во Кина се околу 600000 тони, кои се содржани во наоѓалишта на боксит и фосфорит, наоѓалишта на порфир и волфрамски жили од кварц во Јужна Кина, наоѓалишта на ретки земни руди во Јужна Кина, наоѓалиште на железна руда Бајан Обо во Внатрешна Монголија и наоѓалиште на ванадиум-титаниум-магнетит Панжихуа во Сечуан.
Поради недостигот на скандиум, цената на скандиумот е исто така многу висока, а на својот врв, цената на скандиумот беше надуена до 10 пати поголема од цената на златото. Иако цената на скандиумот падна, таа сè уште е четири пати поголема од цената на златото!
Откривање на историјата
Во 1869 година, Менделеев забележал јаз во атомската маса помеѓу калциумот (40) и титаниумот (48) и предвидел дека тука постои и неоткриен елемент со средна атомска маса. Тој предвидел дека неговиот оксид е X ₂ O Å. Скандиумот бил откриен во 1879 година од Ларс Фредерик Нилсон од Универзитетот во Упсала во Шведска. Тој го ископал од рудникот за црно ретко злато, комплексна руда што содржи 8 вида метални оксиди. Тој ископалЕрбиум(III) оксидод руда од црно ретко злато и добиеноИтербиум(III) оксидод овој оксид, а постои и друг оксид од полесен елемент, чиј спектар покажува дека станува збор за непознат метал. Ова е металот предвиден од Менделеев, чиј оксид еSc₂O₃Самиот метал скандиум бил произведен одСкандиум хлоридсо електролитичко топење во 1937 година.
Менделеев
Електронска конфигурација
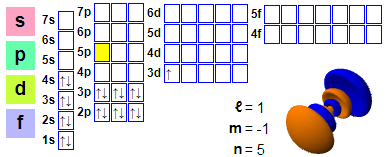
Електронска конфигурација: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Скандиумот е мек, сребрено-бел преоден метал со точка на топење од 1541 ℃ и точка на вриење од 2831 ℃.
Во значителен временски период по неговото откривање, употребата на скандиум не беше демонстрирана поради неговата тешкотија во производството. Со зголеменото подобрување на методите за сепарација на ретките земни елементи, сега постои зрел процес за прочистување на соединенијата на скандиум. Бидејќи скандиумот е помалку алкален од итриумот и лантанидот, хидроксидот е најслаб, па затоа мешаниот минерал на ретките земни елементи што содржи скандиум ќе биде одвоен од ретките земни елементи со метод на „степено таложење“ кога скандиум(III) хидроксидот се третира со амонијак откако ќе се пренесе во раствор. Другиот метод е да се одвои скандиум нитратот со поларна распаѓање на нитратот. Бидејќи скандиум нитратот е најлесен за разградување, скандиумот може да се одвои. Покрај тоа, сеопфатното обновување на придружниот скандиум од ураниум, ториум, волфрам, калај и други минерални наоѓалишта е исто така важен извор на скандиум.
Откако ќе се добие чисто соединение на скандиум, тоа се претвора во ScCl Å и се ко-топи со KCl и LiCl. Растопениот цинк се користи како катода за електролиза, предизвикувајќи скандиум да се таложи на цинковата електрода. Потоа, цинкот испарува за да се добие метален скандиум. Ова е лесен сребрено-бел метал со многу активни хемиски својства, кој може да реагира со топла вода за да генерира водороден гас. Значи, металниот скандиум што го гледате на сликата е запечатен во шише и заштитен со аргонски гас, во спротивно скандиумот брзо ќе формира темножолт или сив оксиден слој, губејќи го својот сјаен метален сјај.
Апликации
Индустрија за осветлување
Употребата на скандиум е концентрирана во многу светли насоки и не е претерување да се нарече Син на Светлината. Првото магично оружје на скандиум се нарекува скандиум натриумова ламба, која може да се користи за да се донесе светлина во илјадници домаќинства. Ова е електрична светилка од метал-халид: сијалицата е исполнета со натриум јодид и скандиум тријодид, а скандиумската и натриумовата фолија се додаваат истовремено. За време на високонапонско празнење, скандиумовите јони и натриумовите јони емитуваат светлина со нивните карактеристични бранови должини на емисија. Спектралните линии на натриумот се 589,0 и 589,6 nm, две познати жолти светла, додека спектралните линии на скандиумот се 361,3~424,7 nm, серија од близу ултравиолетови и сини светлосни емисии. Бидејќи тие се надополнуваат едни со други, вкупната боја на светлината што се произведува е бела светлина. Токму затоа што скандиум натриумовите ламби имаат карактеристики на висока светлосна ефикасност, добра боја на светлината, заштеда на енергија, долг век на траење и силна способност за спречување на магла, тие можат широко да се користат за телевизиски камери, плоштади, спортски објекти и осветлување на патиштата, и се познати како извори на светлина од трета генерација. Во Кина, овој тип на ламби постепено се промовира како нова технологија, додека во некои развиени земји, овој тип на ламби беше широко користен уште од почетокот на 1980-тите.
Второто магично оружје на скандиумот се сончевите фотоволтаични ќелии, кои можат да ја собираат светлината расфрлана на земјата и да ја претворат во електрична енергија за да го движат човечкото општество. Скандиумот е најдобриот бариерен метал во металните изолатори, полупроводнички силициумски сончеви ќелии и сончевите ќелии.
Неговото трето магично оружје се нарекува γ зрачен извор, ова магично оружје може да свети силно само по себе, но овој вид светлина не може да се прими со голо око, тоа е проток на фотони со висока енергија. Обично го извлекуваме 45Sc од минерали, што е единствениот природен изотоп на скандиум. Секое јадро 45Sc содржи 21 протон и 24 неутрони. 46Sc, вештачки радиоактивен изотоп, може да се користи како γ извори на зрачење или атоми на трасер, а може да се користи и за радиотерапија на малигни тумори. Постојат и апликации како итриум-галиум-скандиум-гранет ласер,Скандиум флуоридстаклено инфрацрвено оптичко влакно и катодна цевка обложена со скандиум на телевизија. Се чини дека скандиумот се раѓа со светлина.
Алуминиумска индустрија
Скандиумот во својата елементарна форма е широко користен за допирање на алуминиумски легури. Доколку се додадат неколку илјадити делови од скандиум во алуминиумот, ќе се формира нова фаза Al3Sc, која ќе игра улога на метаморфизам во алуминиумската легура и ќе предизвика значително менување на структурата и својствата на легурата. Додавањето од 0,2%~0,4% Sc (што е навистина слично на пропорцијата на додавање сол во пржениот зеленчук дома, потребно е само малку) може да ја зголеми температурата на рекристализација на легурата за 150-200 ℃ и значително да ја подобри цврстината на високи температури, структурната стабилност, перформансите на заварување и отпорноста на корозија. Исто така, може да се избегне феноменот на кршливост што лесно се јавува при долготрајна работа на високи температури. Алуминиумската легура со висока цврстина и висока цврстина, новата алуминиумска легура отпорна на корозија со висока цврстина, заварливата легура на високи температури, алуминиумската легура отпорна на неутронско зрачење со висока цврстина итн., имаат многу привлечни перспективи за развој во воздухопловството, авијацијата, бродовите, нуклеарните реактори, лесните возила и брзите возови.
Скандиумот е исто така одличен модификатор за железо, а мала количина на скандиум може значително да ја подобри цврстината и тврдоста на леаното железо. Покрај тоа, скандиумот може да се користи и како додаток за легури на волфрам и хром на висока температура. Секако, покрај тоа што се користи за производство на свадбена облека за други, скандиумот има висока точка на топење и неговата густина е слична на алуминиумот, а се користи и во лесни легури со висока точка на топење како што се легура на скандиум и титаниум и легура на скандиум и магнезиум. Сепак, поради високата цена, генерално се користи само во висококвалитетни производствени индустрии како што се вселенски летала и ракети.
Керамички материјал
Скандиумот, како единствена супстанца, генерално се користи во легури, а неговите оксиди играат важна улога во керамичките материјали на сличен начин. Тетрагоналниот циркониумски керамички материјал, кој може да се користи како електроден материјал за горивни ќелии со цврст оксид, има уникатно својство каде што спроводливоста на овој електролит се зголемува со зголемување на температурата и концентрацијата на кислород во околината. Сепак, кристалната структура на овој керамички материјал сама по себе не може да постои стабилно и нема индустриска вредност; потребно е да се допираат некои супстанции што можат да ја фиксираат оваа структура за да се одржат нејзините оригинални својства. Додавањето 6~10% скандиум оксид е како бетонска структура, така што цирконијата може да се стабилизира на квадратна решетка.
Исто така, постојат инженерски керамички материјали како што се силициум нитрид со висока цврстина и отпорност на високи температури како згуснувачи и стабилизатори.
Како згуснувач,Скандиум оксидможе да формира огноотпорна фаза Sc2Si2O7 на работ на фините честички, со што се намалува деформацијата на инженерската керамика при висока температура. Во споредба со другите оксиди, може подобро да ги подобри механичките својства на силициум нитрид при висока температура.
Каталитичка хемија
Во хемиското инженерство, скандиумот често се користи како катализатор, додека Sc2O3 може да се користи за дехидратација и деоксидација на етанол или изопропанол, разградување на оцетна киселина и производство на етилен од CO и H2. Катализаторот PtAl што содржи Sc2O3 е исто така важен катализатор за процесите на прочистување и рафинирање на хидрогенизација на тешки масла во петрохемиската индустрија. Во реакциите на каталитичко крекирање како што е куменот, активноста на Sc-Y зеолитниот катализатор е 1000 пати поголема од онаа на алуминиум силикатниот катализатор; во споредба со некои традиционални катализатори, изгледите за развој на скандиумските катализатори ќе бидат многу светли.
Нуклеарната енергетска индустрија
Додавањето мала количина на Sc2O3 на UO2 во гориво за нуклеарен реактор на висока температура може да ја избегне трансформацијата на решетката, зголемувањето на волуменот и пукањето предизвикано од конверзијата на UO2 во U3O8.
Горивни ќелии
Слично на тоа, додавањето од 2,5% до 25% скандиум во никел-алкалните батерии ќе го зголеми нивниот век на траење.
Земјоделско одгледување
Во земјоделството, семиња како пченка, цвекло, грашок, пченица и сончоглед можат да се третираат со скандиум сулфат (концентрацијата е генерално 10-3~10-8mol/L, различните растенија ќе имаат различна вредност), а постигнат е вистинскиот ефект на поттикнување на 'ртење. По 8 часа, сувата тежина на корените и пупките се зголемила за 37% и 78% соодветно во споредба со садниците, но механизмот сè уште е во фаза на проучување.
Од вниманието на Нилсен кон долгот на податоците за атомската маса до денес, скандиумот влегол во визијата на луѓето само сто или дваесет години, но речиси стоел на клупата сто години. Дури со енергичниот развој на материјалната наука кон крајот на минатиот век, тој му донесе виталност. Денес, ретките земни елементи, вклучувајќи го и скандиумот, станаа жешки ѕвезди во материјалната наука, играјќи постојано менувачки улоги во илјадници системи, носејќи поголема удобност во нашите животи секој ден и создавајќи економска вредност што е уште потешко да се измери.
Време на објавување: 29 јуни 2023 година